1、硫为SP2平面三角形的结构,三个氧结合,至少有3个轨道,硫的最外层有6个电子,氧原子假如每个结合两个电子即达稳态,且无孤对电子,孤对电子不再占用轨道了,那么三个轨道杂化即可,为SP2杂化。

2、宅so3(g)中,no-3的中心原子采用了sp2等性杂化的方式;键角不为120°的三角型。

3、已知so3是sp2杂化,那么s的杂化后是什么样子的,与o是怎么杂化而形成西格玛键的。

4、在so3中,s元素采取了sp2的杂化,在竖直的方向(就是没形成杂化轨道剩下的p轨道)。
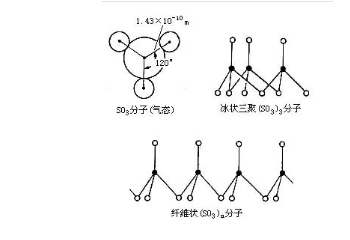
5、我们的工业在制做硫酸时,就会利用催化氧化的反应将so2转化为so3是一个有效的途径。

1、1.了解so3杂化。
2.了解so3结构。
3.了解so3图解。