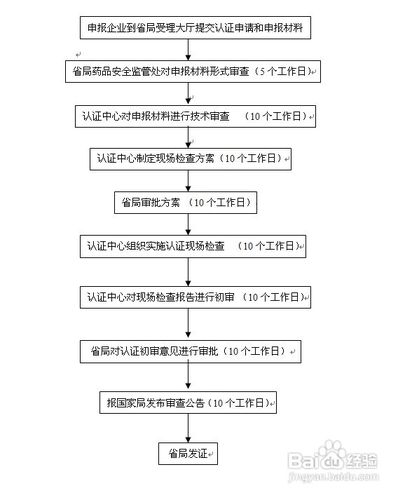
1、申报企业到省局受理大厅提交认证申请和申报材料申请药品GMP认证的药品生产企业(车间)或药品品种,按照《中国药品认证委员会认证管理办法》第四条规定,填写《药品GMP认证申请书》,准备有关资料,一并报中国药品认证委员会秘书处,收取药品GMP认证申请费。
2、省局药品安全监管处对申报材料形式审查 (5个工作日)药品GMP检查办公室对申报的《药品GMP认证申请书》和有关资料进行审查,提出处理意见,报经秘书处批准。 (一)申报的《药品GMP认证申请书》和有关资料符合规定的,药品GMP检查办公室制订药品GMP认证现场检查方案,发《药品GMP认证现场检查通知书》,收取药品GMP认证检查费。 (二)申报资料不能满足审查要求的,发《药品GMP认证补充资料通知书》。 (三)有下列情形之一的不予受理,发《药品GMP认证不受理通知书》,并将《药品GMP认证申请书》和有关资料退回: 1.无《药品生产企业许可》、《药品生产企业合格证》或药品批准文号的。 2.新开办药品生产企业无国家卫生行政等部门批准立项文件的。 3.省、自治区、直辖市药品标准收载的药品品种。 4.试行药品标准的药品品种。 5.其它不符合有关规定的。
3、认证中心对申报材料进行技术审查 (10个工作日)
4、认证中心制定现场检查方案(10个工作日) 药品GMP认证现场检查方案应包括以下主要内容: 1.现场检查的日期及日程安排。 2.检查项目和检查方法。 3.检查组成员及工作分工。
5、省局审批方案 (10个工作日)
6、认证中心组织实施认证现场检查 (10个工作日)1.首次会议 内容主要为介绍检查组成员;确认检查范围;落实日程安排;确定陪同人员;确保检查所需要的资料与记录等。2.现场检查 通过现场参观、检查、提问、查阅文件和记录、谈话、抽样等方式,调查和收集评定的证据。3.检查评定 检查组按照检查项目和检查评定标准对检查范围内施行药品GMP的情况逐项作出评定。评定结果,撰写药品GMP认证现场检查不合格项目情况(附近件6)和药品GMP认证现场检查报告(附件7)。 检查评定期间,药品生产企业的人员应予回避。4.未次会议 检查组向药品生产企业说明现场检查评定情况,交换意见。药品GMP认证现场检查不合格项目情况经检查组全体成员签名及药品生产企业质量控制负责人的认可签名后,双方各持1份。 对有争议的问题,必要时可再核实。双方不能协调的问题,检查组须作好记录并经双方签字,各持1份。
7、认证中心对现场检查报告进行初审 (10个工作日)秘书处对现场检查报告、追踪现场检查报告及评定结果、检验结果及审核意见进行审查,作出综合评定。 综合评定结果为"推荐"的,向药品生产企业以《关于药品GMP认证情况的通报》(附件9)。 综合评定结果为"推迟推荐"的,发《药品GMP认证整改通知书》(附件10)。 限期整改时间不得超过6个月。对认证检验不合格的,整改后须重新抽取样品进行认证检验。 结合评定结果为"不推荐"的,由秘书处发《药品GMP认证结果通知书》(附件11)。
8、省局对认证初审意见进行审批(10个工作日) 根据综合评定结果,由秘书长组织召开认证委员会全体或部分委员参加的审评会,对秘书处呈报的综合评定结果进行审评,报药品认证委员会主任委员签发。特殊情况由秘书长、副秘书长审定,报主任委员签发。
9、报国家局发布审查公告(10个工作日)
10、省局发证批准药品GMP认证的,由秘书处颁发《药品GMP认证证书》(附件12、附件13)和标志,收取批准费、年金。批准药品GMP认证的企业(车间)和药品品种,由中国药品认证委员会发布公告。