1、电子云理论将共价键形成化作了“重叠”的形式,分为σ键与π键的形式,如下图所示。

2、σ键是s轨道两个原子核相互靠近类似于头碰头的形式。π键是p轨道肩碰肩的方式靠近形成的共价键。
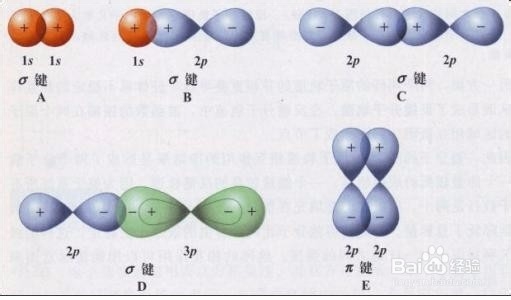
3、σ键与π键相比,π键更容易断裂,所以导致乙烯(CH₂CH₂)和乙烷(CH₃CH₃)的性质并不太一致

4、一个共价键(HCl)有一个σ键,两个共价键(O₂)有一个σ键,一个π键,三个共价键(N₂)有一个σ键,两个π键

5、键能大,键就越稳定,键越短(原子半径相关),键越稳定,键角意味么原子的立体构型的不一致。有平面三角形,直线型等等

6、等电子原理就是原子总数相同,电子总数相同(包括得失的犬匮渝扮)的分子性质相同,找出哪些相同往往需要用替换相邻元素的方式找到。
